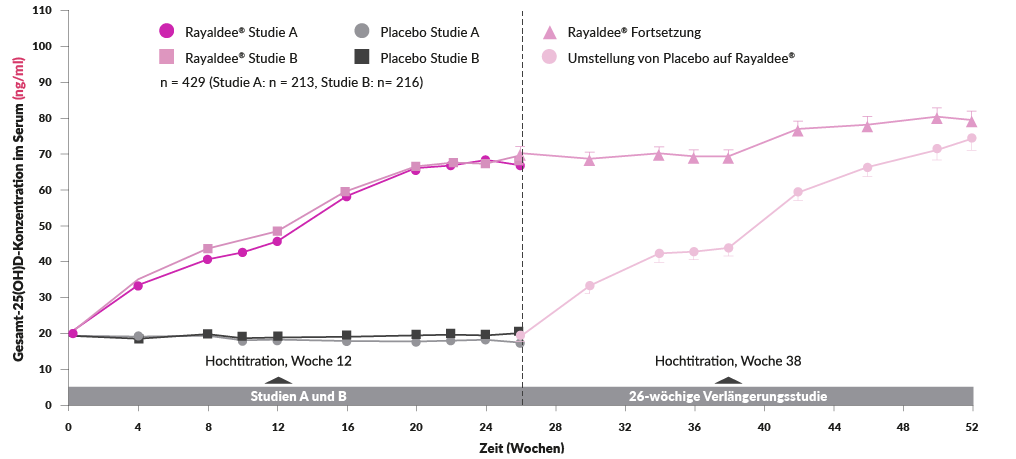
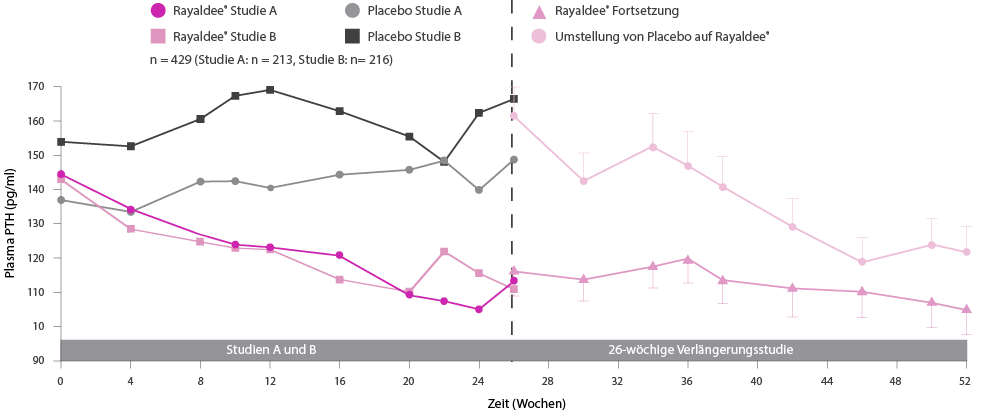
Rayaldee®. Z: Calcifediol als Calcifediol-Monohydrat. I: Behandlung von sekundärem Hyperparathyreoidismus (SHPT) bei Erwachsenen mit chronischer Niereninsuffizienz (CKD) im Stadium 3 oder 4 und 25-Hydroxyvitamin-D-Serumwerten <30 ng/ml. D: Rayaldee® wird einmal täglich mit einer Anfangsdosis von 30 µg vor dem Schlafengehen eingenommen. Nach ungefähr 3 Monaten sollte die Dosis auf 60 µg erhöht werden, wenn das intakte Parathormon (PTH) über dem gewünschten therapeutischen Bereich bleibt. KI: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe. VM: Während der Behandlung kann es zu einer Hyperkalzämie kommen. Hyperkalzämie kann durch die gleichzeitige Verabreichung von hohen Dosen kalziumhaltiger Präparate, Thiaziddiuretika oder anderen Vitamin-D-Präparaten verschlimmert werden. Patienten mit einer Vorgeschichte von Hyperkalzämie sollten während der Therapie noch häufiger auf eine mögliche Hyperkalzämie kontrolliert werden. Patienten sollten über die Symptome von erhöhtem Serumkalzium aufgeklärt werden. Eine erhöhte Phosphataufnahme in Verbindung mit der Einnahme von Vitamin-D-Präparaten kann zu Hyperphosphatämie führen. Patienten mit einer Vorgeschichte von Hyperphosphatämie sollten während der Therapie noch häufiger auf eine mögliche Hyperphosphatämie kontrolliert werden. Adynamische Osteopathie mit daraus resultierender erhöhter Gefahr von Frakturen kann sich entwickeln, wenn die Konzentrationen des intakten PTH über längere Zeit übermässig unterdrückt werden. Die Konzentrationen des intakten PTH sollten kontrolliert und die Rayaldee®-Dosis ggf. angepasst werden. S/S: Rayaldee® darf während der Schwangerschaft nicht angewendet werden und bei stillenden Müttern ist Vorsicht geboten. UAW: Häufig: erhöhtes Phosphat im Blut, Hyperkalzämie, Verstopfung, Übelkeit, Diarrhö. Gelegentlich: verminderter Appetit, Schwindelgefühl, Kopfschmerzen, Abdominalschmerzen, Mundtrockenheit, Erbrechen und Asthenie. IA: Es wurden keine spezifischen Studien mit Rayaldee® zur Erfassung von möglichen Interaktionen durchgeführt. Bei folgenden Begleittherapien müssen die Serumwerte von 25-Hydroxyvitamin-D, intaktem PTH und/oder Kalzium überwacht und ggf. die Rayaldee®-Dosis angepasst werden: Cytochrom-P450-Hemmer, wie z.B. Ketoconazol, Atazanavir, Clarithromycin, Indinavir, Itraconazol, Nefazodon, Nelfinavir, Ritonavir, Saquinavir, Telithromycin oder Voriconazol, können am Vitamin-D-Stoffwechsel beteiligte Enzyme (CYP24A1 und CYP27B1) hemmen. Thiaziddiuretika senken die Ausscheidung von Kalzium über den Urin und können das Risiko einer Hyperkalzämie erhöhen. Die gleichzeitige Verabreichung von Thiaziddiuretika und Rayaldee® kann Hyperkalzämie verursachen. Hyperkalzämie kann während der Behandlung mit Rayaldee® auftreten, wodurch das Risiko einer Digitalis-Toxizität erhöht wird (Risiko von Arrhythmien). Cholestyramin vermindert die Aufnahme fettlöslicher Vitamine im Darm und kann die Aufnahme von Calcifediol beeinträchtigen. Phenobarbital oder andere Antiepileptika bzw. andere Präparate, die die mikrosomale Hydroxylierung stimulieren (CYP24A1 und CYP27B1 Induktoren), senken die Halbwertszeit von Calcifediol. P: Flasche mit 30 Weichkapseln retardiert zu 30 µg. Liste B. Detaillierte Informationen: www.swissmedicinfo.ch. Zulassungsinhaberin: Vifor Fresenius Medical Care Renal Pharma Ltd., CH-9001 St. Gallen. Vertrieb: Vifor Pharma Switzerland AG, CH-1752 Villars-sur-Glâne. Stand: Januar 2022.
![]()